¿Qué son los nucleones?
a) Electrones y protones en el núcleo del átomo.
b) Neutrones y protones en el núcleo del átomo.
c) Electrones y protones en el núcleo del átomo.
b) Neutrones y protones en el núcleo del átomo.
Un nucleón corresponde al nombre colectivo para dos partículas: el neutrón y el protón.
Partícula subatómica que se encuentra en los orbitales de un átomo y que fue descubierta en 1897 por Joseph John Thompson.
Electrones: partículas subatómicas con carga eléctrica negativa que representan menos del 0,06% de la masa total del átomo y que orbitan alrededor del núcleo.
¿Qué es la configuración electrónica?
a)Es una tabla de elementos según su número atómico.
b) Son electrones ordenados en distintos canales.
c) Es como están ordenados los electrones en los distintos niveles de energía (órbitas).
c) Es como están ordenados los electrones en los distintos niveles de energía (órbitas)
¿Quién descubrió el núcleo del átomo?
a) Rutherford.
b) Bohr.
c) J. Dalton.
d) R. Millikan.
a) Rutherford.
El número atómico Z de un átomo indica
a) El número de neutrones que posee un átomo.
b) El número de protones que posee un átomo.
c) El número de neutrones y protones que posee un átomo.
d) El número de electrones que posee un átomo.
b) El número de protones que posee un átomo.
¿Cuál es la configuración electrónica correcta del nitrógeno si sabemos que su número atómico es 7
a)1s2 2s2 2p3
b)1s3 2s3 2p1
c)1s5 2s2
a)1s2 2s2 2p3
¿Cuál es la partícula subatómica que tiene mayor peso en el átomo?
a) Neutrón
b) Protón
c) Electrón
d) Núcleo
a) Neutrón
El electrón se caracteriza por.
a) se mueven más rápido que la velocidad de la luz.
b) poseer una carga positiva.
c) Que se mueven dentro del núcleo.
d) ninguna de las anteriores.
d) ninguna de las anteriores.
Un electrón es una partícula que se caracteriza por tener una carga eléctrica negativa.
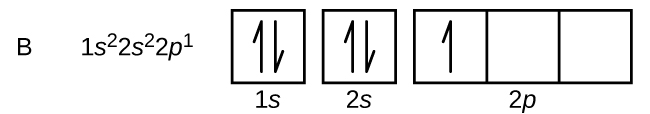
¿A que elemento pertenece este diagrama de orbitales?
a) Boro
b) Nitrógeno
a) Boro
¿Qué es un isótopo?
a) aquellos átomos con distinto número atómico y mismo número masico
b) aquellos átomos con mismo número atómico y mismo número masico
c) aquellos átomos con mismo número atómico pero distinto número másico
d) aquellos átomos con distinto número atómico y distinto número masico
c) aquellos átomos con mismo número atómico pero distinto número másico
Las órbitas más cercanas al núcleo requieren:
a) Niveles más altos de energía
b) Niveles más bajos de energía de atracción
c) Niveles con incompleto número de electrones
d) Todas son incorrectas
b) Niveles más bajos de energía de atracción
Las órbitas más cercanas al núcleo requerirían cantidades menores de energía para un electrón y las órbitas más alejadas del núcleo requerirían que los electrones tuvieran una mayor cantidad de energía.
¿Cuántos electrones máximos podemos tener en cada Nivel de Energía?
a) Nivel 1: 2
Nivel 2:8
Nivel 3:18
Nivel 4:32
Nivel 5:46
Nivel 6:58
Nivel 7:70
b) Nivel 1: 5
Nivel 2:10
Nivel 3:15
Nivel 4:20
Nivel 5:25
Nivel 6:30
Nivel 7:35
c)Nivel 1: 2
Nivel 2:8
Nivel 3:18
Nivel 4:32
Nivel 5:32
Nivel 6:18
Nivel 7:8
c)Nivel 1: 2
Nivel 2:8
Nivel 3:18
Nivel 4:32
Nivel 5:32
Nivel 6:18
Nivel 7:8
Los núcleos atómicos con el mismo número de protones pero distinto número de neutrones se denominan _______. Los núcleos atómicos con el mismo número de neutrones se denominan _______.
a) estables, inestables.
b) isotopos, isótonos.
c) aniones, cationes.
Los núcleos atómicos con el mismo número de protones pero distinto número de neutrones se denominan isótopos. Los núcleos atómicos con el mismo número de neutrones se denominan isótonos.
¿Qué establece el principio de mínima energía o de Aufbau?
a) indica que los electrones deben ocupar los orbitales en orden creciente de energía, ya que, el estado de mínima energía es el más estable.
b) establece que en un átomo no puede haber dos electrones con los cuatro números cuánticos idénticos.
c) indica que cuando se asignan electrones a los orbitales de un mismo subnivel, se coloca un electrón desapareado en cada orbital del subnivel, luego se completan los orbitales posibles con electrones con espines opuestos.
a) indica que los electrones deben ocupar los orbitales en orden creciente de energía, ya que, el estado de mínima energía es el más estable.
¿Cuál de las siguientes configuraciones es errónea?
a) Cloro 17 = 1s2 2s2 2p6 3s2 3p5
b) Argón 18 = 1s2 2s2 2p6 3s2 3p6
c) Potasio 19 = 1s2 2s2 2p6 3s2 3p6 4s1
d) Calcio 20 = 1s2 2s2 2p4 3s2 3p6 4s2
e) Todas son correctas.
d) Calcio 20 = 1s2 2s2 2p4 3s2 3p6 4s2
Forma correcta: Calcio 20 = 1s2 2s2 2p6 3s2 3p6 4s2