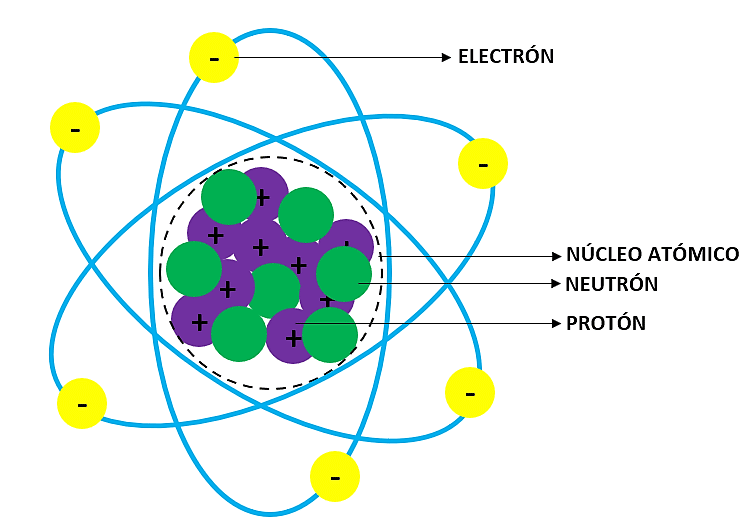
¿Cuáles son las partes del átomo?
Enlace que se produce en 2 átomos no metálicos cuando comparten uno o más electrones del último nivel nivel para completar el octeto
¿Qué es el enlace covalente?
Estudio de las cantidades de materia consumida y producida en las reacciones químicas
¿Qué es estequiometría?
Definen la proporción entre el soluto y el solvente en masa, volumen o sus partes
¿Cuáles son las unidades físicas de concentración de soluciones?
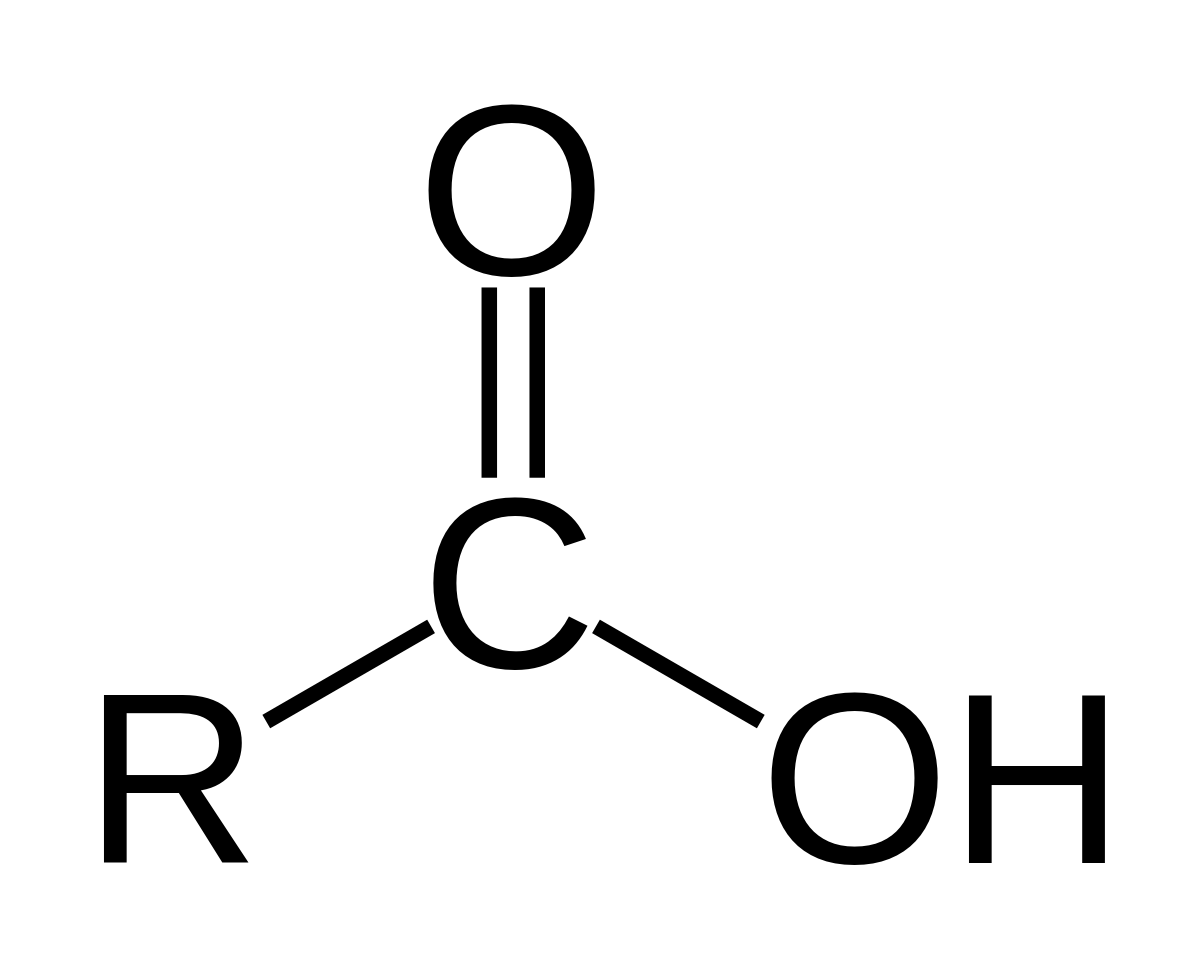
¿Cuál es el grupo funcional de un ácido orgánico?
1.60 x 10^-19 C
¿Cuál es la carga del electrón?
Enlace formado por transferencia de uno o más electrones de un átomo o grupo de átomos a otro
¿Qué es el enlace iónico?
Método de tanteo y método algebraico
¿Cuáles son los métodos de balanceo de ecuaciones químicas?
Concentración de una solución expresada en el número de moles disueltos por litro de disolución.
¿Qué es molaridad?
Sustancia que al disolverse en agua libera iones hidroxilo (OH–)
¿Qué es una base química?
La materia está formada por partículas muy pequeñas llamadas átomos, que son indivisibles y no se pueden destruir

¿Qué es el modelo atómico de Dalton?
- Buenos conductores de calor y de electricidad.
- Predomina en ellos el enlace iónico (electrovalente).
- Tienen puntos de fusión y ebullición.
- Algunos sólidos, suelen presentar dureza y fragilidad.
- Suelen organizarse en forma de cristales cuando son sales sólidas, debido a la falta de movilidad entre sus iones.
¿Cuáles son las propiedades de los compuestos inorgánicos?
Representación escrita de una reacción química
¿Qué es una ecuación química?
¿Cuáles son las soluciones diluidas, saturadas y sobresaturadas?

¿Cuáles son ejemplo de ácidos?

¿Cuál es el modelo atómico de Thomson?
Compuestos que resultan de la unión de oxígeno (O2) con cualquier elemento de la tabla periódica sea metal (óxidos básicos) o no metal (óxidos ácidos)
¿Qué es un óxido?
La cantidad de átomos de cada tipo que forman cada agrupación de átomos (molécula)
¿Qué son los subíndices en una ecuación química?
Número de moles de soluto en una solución correspondiente a 1 kg o 1000 g de disolvente
¿Qué es molalidad?
Solución compuesta por una mezcla de un ácido débil con su base conjugada. Su principal característica es que mantiene estable el pH de una disolución ante la adición de cierta cantidad de ácido o base fuerte.
¿Qué es una solución amortiguadora?

¿Cuál es el Modelo Atómico de Bohr?

¿Qué es el peróxido de sodio?
Modificar los coeficientes de uno y otro lado de la ecuación hasta que se cumplan las condiciones de balance de masa
¿Qué es el método de balanceo por tanteo?
Solución que contiene 10 gramos de soluto en 90 gramos de disolvente.
¿Qué es una solución al 10% m/m?

¿Que es la ecuación de la constante de equilibrio?