¿Qué científico retomó la idea de átomo que propuso Demócrito y quedó durante siglos en el olvido por la opinión de Aristóteles?
Dalton
Indica a qué modelo hace referencia la siguiente frase:
El átomo es una "bola" cargada positivamente en la que están incrustados los electrones.
Modelo atómico de Thomson
El modelo atómico de Böhr se conoce como modelo atómico de .....
Capas
¿Cómo definirías el término orbital atómico?
Región del espacio en la que existe una probabilidad elevada de encontrar al electrón.
¿Qué muestra el siguiente diagrama y para qué se utiliza?

El orden de llenado de los electrones en los orbitales en orden creciente de energía.Se usa para hacer las configuraciones electrónicas de los átomos.
¿Cuál es el nombre de los elementos representados por los símbolos que se indican?
Mg
Br
Mn
B
Mg: Magnesio
Br: Bromo
Mn: Manganeso
B: Boro
¿Cuál es la capa de valencia de los elementos del grupo 1 y qué carga tiene el ion más estable que forman?
ns1
Carga +1
¿Cuántos protones,neutrones y electrones tiene un átomo neutro con Z=11 y A=23?
11 protones
11 electrones
12 neutrones
¿Qué científico realizó este experimento?
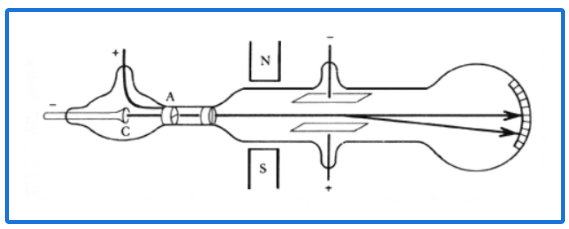
Thomson
¿Con qué científico relacionarías la siguiente afirmación?
Los átomos de un mismo elemento son todos iguales entre sí en masa, tamaño y en el resto de las propiedades físicas o químicas. Por el contrario, los átomos de elementos diferentes tienen distinta masa y propiedades.
Teoría atómica de Dalton
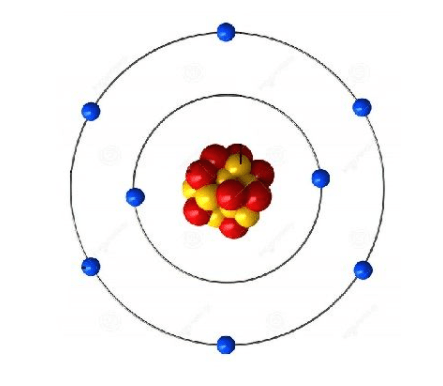
¿Qué modelo atómico representa esta imagen?
Explica cómo es el átomo según dicho modelo.
Modelo atómico de Rutherford.
El átomo está formado por un núcleo pequeño donde está la carga positiva(protones) y se concentra casi toda la masa del átomo,espacio vacío y los electrones giran alrededor del núcleo en la corteza, describiendo órbitas planetarias.
¿Todos los orbitales del mismo nivel tienen el mismo tamaño o la misma forma?
El mismo tamaño
¿Cuántos electrones puede haber como mucho en cada orbital?
2 electrones con espines contrarios.
¿Cuántos grupos y periódos hay en la tabla periódica?
18 grupos y 7 periódos
¿En qué grupo y período se encuentra el helio?
Grupo 18,período 1
¿Cuál es la carga de un átomo que tiene 16 neutrones,16 protones y 18 electrones?
¿Es un catión,anión o átomo neutro?
Es un anión con carga -2
¿Qué partícula subatómica se descubrió con este experimento?
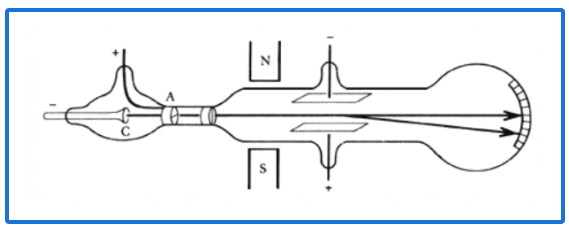
Electrones
La siguiente afirmación hace referencia al problema que presentaba qué modelo atómico:
Si el electrón girase alrededor del núcleo como un planeta alrededor del Sol,emitiría energía.Esto le llevaría a describir una espiral que finalizaría con el electrón cayendo en el núcleo.
Modelo atómico de Rutherford
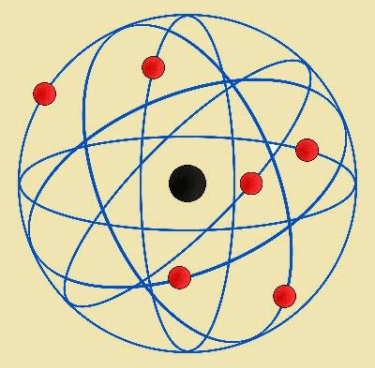
¿Qué modelo atómico representa esta imagen?
Explica cómo es el átomo según dicho modelo.
Modelo atómico de Böhr
El átomo está formado por un núcleo donde se encuentran protones y neutrones,y una corteza donde se encuentran los electrones moviéndose en determinadas órbitas,en determinadas capas o niveles donde tienen cierta energía.
¿Qué tipos de orbitales podemos encontrar en el átomo?
Orbitales tipo s,p,d,f
Escribe la configuración electrónica del potasio(Z=19).
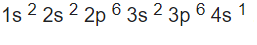
¿Qué tienen en común los elementos de un mismo grupo?
Los mismos electrones en la capa de valencia y, por ello,comportamiento químico similar.
Ordena en orden creciente de tamaño los siguientes átomos:
I,F,Br,Cl
F<Cl<Br<I
Todos los átomos de un mismo elemento tienen el mismo número de:
a)electrones
b)protones
c)neutrones
protones
¿Qué científicos realizaron esta experiencia y cuál es el nombre de la misma?
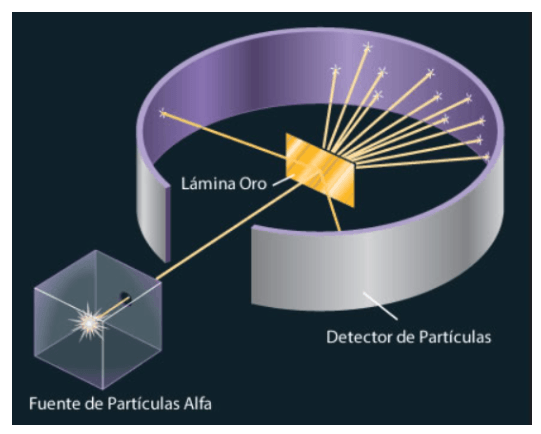
Ernest Rutherford y sus colaboradores Hans Geiger y Ernest Marsden.
Es la experiencia de la lámina de oro.
¿En qué modelo atómico apareció el concepto de orbital?
Modelo atómico actual
¿Cuáles son los dos hechos relativos al átomo que no explica el modelo atómico de Rutherford y a los que dio respuesta Böhr?
-La estabilidad del átomo.
-El espectro de los átomos.
¿Qué tipos de orbitales aparecen representados en la imagen?
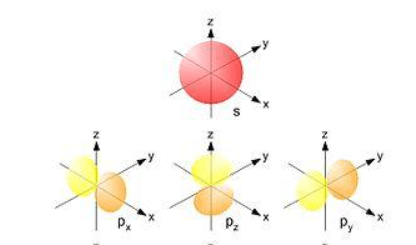
Orbital s y orbitales p
El oxígeno tiene como número atómico z= 8.¿Cuál de las siguientes distribuciones electrónicas en sus orbitales,indicados mediante cajas, es la correcta y por qué?
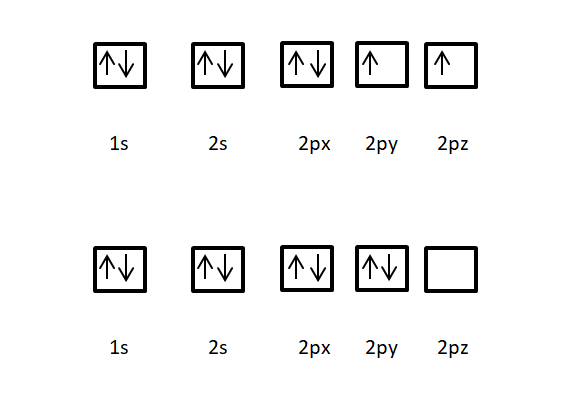
La correcta es la primera porque primero se llenan los electrones con espines paralelos y luego se van llenando con espines contrarios,por ser así el átomo más estable.
¿Cuál es la capa de valencia de los gases nobles y qué particularidad presentan respecto a su comportamiento químico debido a esos electrones de valencia?
ns2np6
8 electrones en la capa de valencia(regla del octeto),octeto completo. Son estables y no se unen con otros átomos.
Ordena en orden creciente de tamaño los siguientes átomos:
S,Al,Na,Si
S<Si<Al<Na
Los isótopos son átomos de un mismo elemento con distinto número:
a) másico
b)atómico
Distinto número másico,distinto número de neutrones.
Los científicos Millikan y Fletcher llevaron a cabo este experimento,mediante el que consiguieron determinar...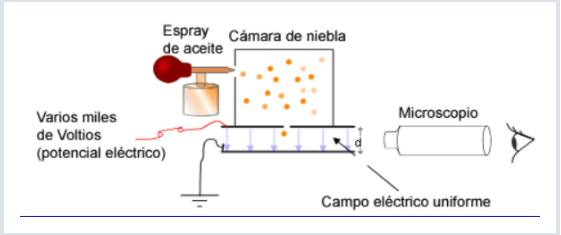
La carga del electrón
¿Qué científico determinó la existencia de una tercera partícula subatómica llamada neutrón?
¿Cuándo lo hizo?
Fue Chadwick en 1932.
El descubrimiento del protón se atribuye a Rutherford,no obstante hubo otro científico que años atrás realizó otra experiencia parecida a la del tubo de rayos catódicos de Thomson que le permitió observar que había en el átomo partículas con carga positiva,¿quién fue este científico?
Goldstein
¿Cuántos orbitales de cada tipo hay por nivel?
1 orbital s
3 orbitales p
5 orbitales d
7 orbitales f
¿Cuáles son los electrones de valencia de los siguientes átomos?

A: 1s2
B: 3s1
C: 3s23p5
D:3d5
¿Cuál será el ion más estable que formará el fluor (z=9)?
F-: 1s22s22p6
Clasifica los siguientes elementos en metales y no metales:
Oxígeno Cloro
Litio Platino
Zinc Manganeso
Metales: Li,Pt,Zn,Mn
No metales: O,Cl
Las partículas subatómicas con masa despreciable son los .......... y tienen carga ...........
electrones
negativa