A ferrugem que aparece no ferro é resultado de:

a) Oxidação do ferro em presença de oxigênio e água
b) Redução direta do oxigênio
c) Dissolução do ferro em ácido clorídrico
d) Ação mecânica da umidade
a) Oxidação do ferro em presença de oxigênio e água
O que é uma pilha eletroquímica?
:quality(80)/broketto/catalog/duracell/01717/pilha-alcalina-aa-2-unidades-duracell-6.jpg)
a) Um dispositivo que armazena energia mecânica
b) Um dispositivo que converte energia química em energia elétrica
c) Um capacitor de alta voltagem
d) Um tipo de motor elétrico
b) Um dispositivo que converte energia química em energia elétrica
As pilhas comuns usadas em controles remotos e lanternas são classificadas como:
a) Secundárias (recarregáveis)
b) Primárias (não recarregáveis)
c) Baterias de fluxo
d) Combustíveis
b) Primárias (não recarregáveis)
O nome “pilha” vem de:
a) Thomas Edison, que descobriu a eletrólise
b) Michael Faraday, que criou baterias de chumbo
c) Galileu, que estudava eletricidade
d) Alessandro Volta, que empilhou discos metálicos
d) Alessandro Volta, que empilhou discos metálicos
Quanto maior a diferença de potencial (ddp) em uma pilha, maior será:

a) A intensidade da corrente elétrica gerada
b) A quantidade de eletrólito consumido
c) A vida útil da ponte salina
d) A massa do cátodo metálico
a) A intensidade da corrente elétrica gerada
Uma das formas mais comuns de prevenir a corrosão em automóveis é:
a) Uso de ácido para remover o óxido
b) Aplicação de tinta protetora
c) Esfregar com lã de aço periodicamente
d) Lixar o metal exposto com frequência
b) Aplicação de tinta protetora
No eletrodo onde ocorre oxidação temos:
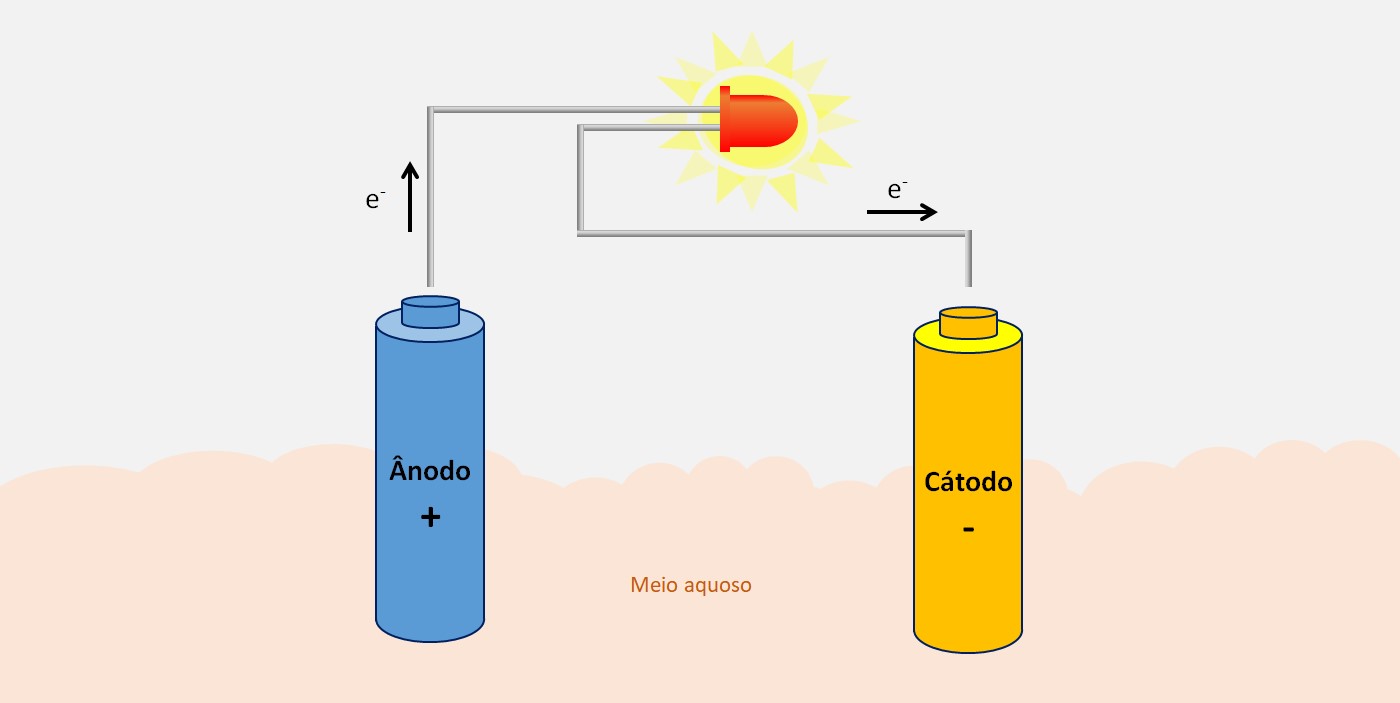
a) O cátodo
b) O ânodo
c) A ponte salina
d) O eletrólito
b) O ânodo
Qual é a principal diferença entre uma pilha e uma bateria?
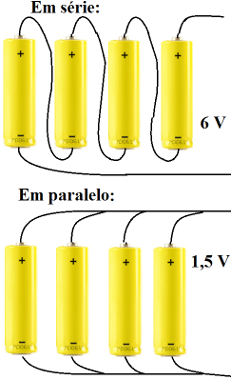
a) A bateria é formada por várias pilhas associadas
b) A pilha é sempre recarregável
c) A bateria só armazena energia mecânica
d) A bateria não utiliza eletrólitos
a) A bateria é formada por várias pilhas associadas
O famoso “Volts”, unidade de ddp, é uma homenagem a:

a) Luigi Galvani
b) Michael Faraday
c) Alessandro Volta
d) André-Marie Ampère
c) Alessandro Volta
Se o E° de redução do Cu²⁺/Cu é +0,34 V e do Zn²⁺/Zn é -0,76 V, a ddp da pilha é:
a) 0,42 V
b) 1,10 V
c) -0,42 V
d) -1,10 V
b) 1,10 V
Na proteção catódica (metal de sacrifício), o ferro é protegido porque:
a) Age como ânodo e se dissolve
b) É conectado a um metal menos reativo
c) É conectado a um metal mais reativo
d) É isolado do contato com água
c) É conectado a um metal mais reativo
Em uma pilha de Daniell (Zn/Cu), o zinco sofre:
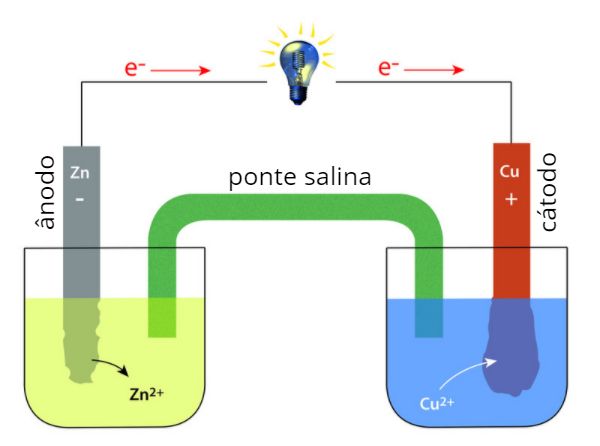
a) Redução, pois recebe elétrons
b) Oxidação, pois perde elétrons
c) Nenhuma reação
d) Dissolução neutra
b) Oxidação, pois perde elétrons
O efeito memória está associado a:

a) Pilhas alcalinas
b) Baterias de níquel-cádmio
c) Baterias de chumbo-ácido
d) Pilhas de Daniell
b) Baterias de níquel-cádmio
O famoso “efeito pilha de Daniell” foi essencial para:
a) A invenção da fotografia
b) O desenvolvimento do telégrafo
c) A criação da lâmpada
d) A descoberta da eletrólise
b) O desenvolvimento do telégrafo
A ddp em uma pilha é responsável por:
a) Fornecer energia térmica ao sistema
b) Garantir o fluxo de elétrons do cátodo para o ânodo
c) Manter o fluxo de elétrons do ânodo para o cátodo
d) Impedir a reação química
c) Manter o fluxo de elétrons do ânodo para o cátodo
A Estátua da Liberdade, em Nova Iorque, originalmente tinha a cor marrom metálica, mas hoje apresenta coloração esverdeada. Essa mudança ocorreu devido:

a) À oxidação do ferro presente na estrutura, formando ferrugem.
b) À oxidação do cobre de sua superfície, formando uma camada de carbonato básico de cobre (pátina verde).
c) À deposição de algas e microrganismos em sua superfície.
d) À aplicação de tinta protetora verde para reduzir a corrosão.
b) À oxidação do cobre de sua superfície, formando uma camada de carbonato básico de cobre (pátina verde).
Uma pilha de Daniell (Zn/Cu) foi deixada em funcionamento até se esgotar. O que ocorreu com as massas dos eletrodos?
a) O eletrodo de Zn aumentou de massa e o de Cu diminuiu.
b) O eletrodo de Zn diminuiu de massa e o de Cu aumentou.
c) Ambos os eletrodos diminuíram de massa.
d) Ambos os eletrodos aumentaram de massa.
b) O eletrodo de Zn diminuiu de massa e o de Cu aumentou.
A bateria de chumbo-ácido é amplamente utilizada em:
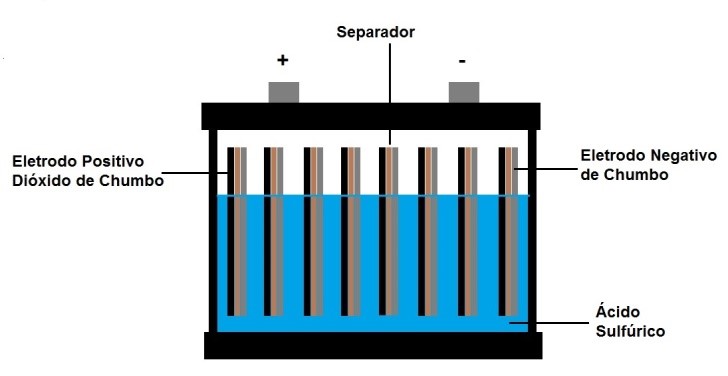
a) Relógios de pulso
b) Automóveis
c) Celulares
d) Calculadoras
b) Automóveis
O prêmio Nobel de 2019 foi dado a cientistas que desenvolveram:

a) Pilha de Daniell
b) Baterias de íon-lítio
c) Pilha de combustível a hidrogênio
d) Células solares
b) Baterias de íon-lítio
Se a ddp calculada for negativa, isso indica que:
a) A reação é espontânea
b) A reação não é espontânea
c) A ponte salina está bloqueada
d) O ânodo mudou de polaridade
b) A reação não é espontânea
A corrosão do ferro na presença de oxigênio e umidade leva à formação de ferrugem, que é principalmente Fe₂O₃·xH₂O. Esse processo envolve reações eletroquímicas simultâneas em diferentes regiões da superfície do ferro. Qual alternativa descreve corretamente o que acontece?
a) O ferro atua como cátodo em toda a superfície, sendo reduzido a Fe²⁺.
b) Parte da superfície do ferro funciona como ânodo, sofrendo oxidação a Fe²⁺, enquanto outra parte funciona como cátodo, onde o O₂ é reduzido em meio aquoso.
c) O ferro se dissolve uniformemente por ação da água, sem reações de oxirredução.
d) A ferrugem é formada pela simples combinação direta de ferro metálico com água.
b) Parte da superfície do ferro funciona como ânodo, sofrendo oxidação a Fe²⁺, enquanto outra parte funciona como cátodo, onde o O₂ é reduzido em meio aquoso.
Dados os potenciais padrão de redução:
Ni²⁺/Ni = –0,25 V
Ag⁺/Ag = +0,80 V
Se montarmos uma pilha com Ni e Ag, qual metal será oxidado e qual será reduzido?
a) Ni será reduzido e Ag será oxidado.
b) Ni será oxidado e Ag será reduzido.
c) Ambos serão reduzidos.
d) Ambos serão oxidados.
b) Ni será oxidado e Ag será reduzido.
Qual é uma vantagem das baterias de íon-lítio em relação a outras?

a) Menor densidade de energia
b) Maior efeito memória
c) Alta densidade de energia e recarregáveis
d) Maior peso e menor durabilidade
c) Alta densidade de energia e recarregáveis
Por que a pilha de batata/limão não consegue alimentar aparelhos maiores, como um celular?
a) Porque o alimento não conduz elétrons
b) Porque a ddp gerada é muito baixa
c) Porque o zinco e o cobre não reagem
d) Porque o alimento impede a passagem de íons
b) Porque a ddp gerada é muito baixa
Os potenciais padrão de redução são:
Ag⁺/Ag = +0,80 V
Cu²⁺/Cu = +0,34 V
Se construirmos uma pilha com esses dois eletrodos, a ddp padrão será:
a) 0,46 V
b) 1,14 V
c) –0,46 V
d) 0,34 V
a) 0,46 V
