Teniendo en cuenta la siguiente representación de un elemento X: 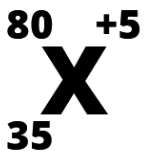
Se puede afirmar que:
A. El número de electrones es 30
B. El número de electrones es 75
C. El número de electrones es 85
D. El número de electrones es 40
A. El número de electrones es 30 (35 - 5)
Teniendo en cuenta el siguiente gráfico, ¿qué palabras van en los numerales 3 y 4?
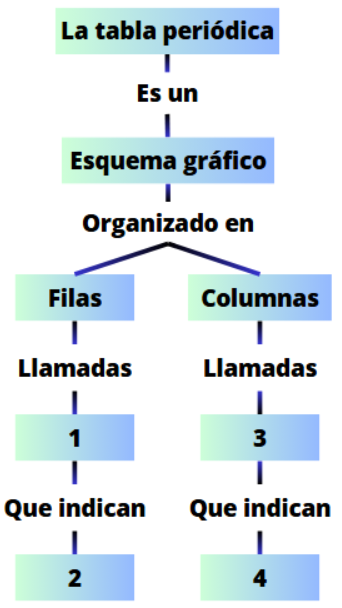
A. 3: grupos - 4: niveles de energía
B. 3: periodos - 4: electrones de valencia
C. 3: grupos - 4: electrones de valencia
D. 3: periodos - 4: niveles de energía
C.
3. Grupos
4. Indican los grupos o familias químicas y a su vez el número de electrones de valencia.
El nombre trióxido de dicloro es incorrecto para Cl2O3, ya que el prefijo numérico no corresponde a la proporción real de los átomos en la molécula.
¿Falso o verdadero?
Falso. La fórmula indica tres oxígenos (trióxido) y dos cloros (dicloro). Por lo tanto el nombre es correcto y corresponde a la fórmula Cl2O3
En una reacción de combustión, es necesario que el oxígeno actúe como comburente y los productos son generalmente dióxido de carbono y agua.
¿Falso o verdadero?
Verdadero. Sin oxígeno no hay combustión.
En una ecuación redox, el número de electrones cedidos en la oxidación debe ser igual al número de electrones ganados en la reducción.
¿Falso o verdadero?
Verdadero. Esto debe cumplir a la ley de conservación de la masa y la energía.
Teniendo en cuenta la siguiente representación de un elemento X:
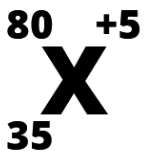
Se puede afirmar que:
A. El número de neutrones es 45
B. El número de neutrones es 80
C. El número de neutrones es 85
D. El número de neutrones es 40
El número de neutrones es 45 (80 - 35)
Teniendo en cuenta el siguiente gráfico, ¿qué palabras van en los numerales 1 y 2?

A. 1: grupos - 2: niveles de energía
B. 1: periodos - 2: electrones de valencia
C. 1: grupos - 2: electrones de valencia
D. 1: periodos - 2: niveles de energía
D.
1. Periodos
2. Indican el número de niveles de energía y/o la última capa electrónica llena en un átomo.
En la nomenclatura de los oxoácidos, el sufijo –oso indica menor número de átomos de oxígeno que el sufijo –ico.
¿Falso o verdadero?
Verdadero.
El sufijo -oso indica el menor estado de oxidación, por lo tanto menor cantidad de átomos de oxígeno
En una reacción de síntesis, dos o más sustancias simples se combinan para formar una sustancia más compleja. Un ejemplo de reacción de síntesis es:
KClO3 → KCl + O2
Respecto al ejemplo, ¿será Falso o verdadero?
Falso. La ecuación de reacción representa una reacción de descomposición
En el método de balance por tanteo, se modifican los subíndices de las fórmulas para igualar los átomos a ambos lados de la ecuación.
¿Falso o verdadero?
Falso. Los subíndices no se modifican, lo que se modifica son los coeficientes.
Los isótopos son elementos que tienen el mismo número de protones pero diferente número de neutrones, por lo tanto diferente masa. Los isóbaros son diferentes elementos que tienen igual masa a pesar de presentar diferente número atómico.
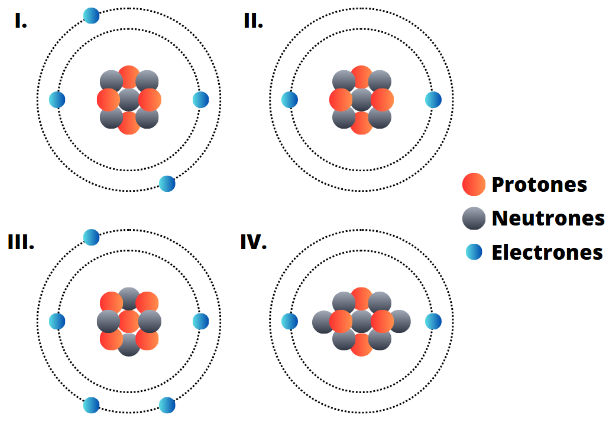
Según la anterior información. ¿Cuáles de las siguientes representaciones son isóbaros?
A. I y II
B. II y IV
C. II y III
D. I y IV
C. II y III
¿Cuál de los siguientes elementos representados con las letras X, W, Y y Z corresponde a la configuración electrónica 1s22s22p63s23p64s23d104p1?
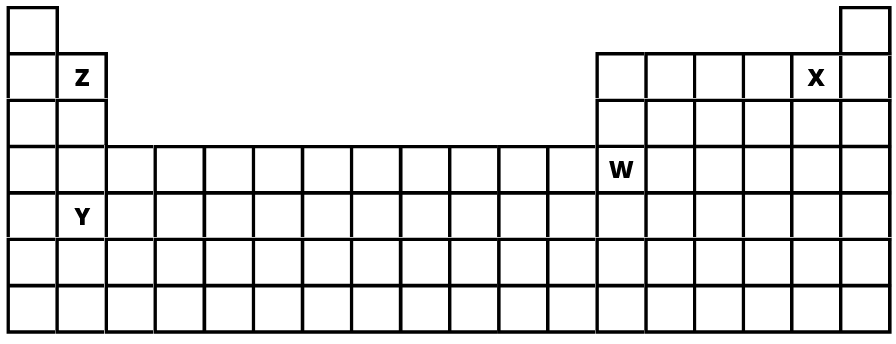
W
Sabiendo que el azufre tiene estados de oxidación -2, +4, +6, y el potasio es monovalente y tiene carga +1, entonces el nombre de sulfuro de potasio corresponde a la fórmula:
A. SK2
B. P2S
C. K2S
D. K6S
C. K2S
En la reacción:
AgNO3 + KBr → AgBr + KNO3
Se observa:
A. Una reacción de síntesis con transferencia de electrones.
B. Una reacción de descomposición endotérmica.
C. Una reacción doble sustitución sin cambio de valencia.
C. Una reacción doble sustitución sin cambio de valencia.
Se tiene la siguiente ecuación de reacción parcialmente balanceada:
2 KMnO4 + X HCl → 2 KCl + 2 MnCl2 + Y H2O + 5 Cl2
Para balancear correctamente, es necesario que los coeficientes X y Y sean respectivamente:
A. 14 y 7
B. 16 y 8
C. 10 y 5
B. 16 y 8
Los isótopos son elementos que tienen el mismo número de protones pero diferente número de neutrones, por lo tanto diferente masa.

Según la imagen. ¿Cuáles de las siguientes representaciones son isótopos?
A. I y II
B. I y III
C. II y III
D. I y IV
D. I y IV
¿Cuál de los siguientes elementos representados con las letras X, W, Y y Z tendrá el radio atómico más grande? 
Y
Teniendo en cuenta los estados de oxidación del cloro (-1, +1, +3, +5 y +7) y del cobalto (+2 y +3),
La fórmula CoCl3 corresponde a:
A. Cloruro cobaltoso
B. Clorato cobaltoso
C. Cloruro cobáltico
D. Hipoclorito cobáltico
C. Cloruro cobáltico
El compuesto SO2 reacciona con agua para formar H2SO3. Según la naturaleza de la reacción y los compuestos involucrados, se trata de:
A. Una reacción de síntesis entre un óxido ácido y agua.
B. Una reacción de descomposición de un ácido oxácido.
C. Una reacción de desplazamiento entre un óxido básico y un ácido.
A. Una reacción de síntesis entre un óxido ácido y agua.
Se tiene la siguiente ecuación de reacción:
KClO3 → KCl + O2
Los coeficientes que balancean correctamente la reacción son:
A. 1, 2 y 3
B. 2, 2 y 3
C. 1, 1 y 2
B. 2, 2 y 3
Los átomos neutros son aquellos que presentan el mismo número de protones y electrones, de esta forma las cargas positivas y negativas se anulan dando lugar a una carga neutra cuyo valor es cero.

Según la anterior información. ¿Cuáles de las siguientes representaciones son átomos neutros?
A. I y II
B. I y III
C. II y III
D. I y IV
B. I y III
¿Cuál de los siguientes elementos representados con las letras X, W, Y y Z tendrá mayor electronegatividad?

X
El hidróxido cuproso corresponde a la fórmula:
A. CuO
B. HCuO
C. CuOH
D. CuOx
C. CuOH
En la reacción: N2 + H2 → NH3
Se observa:
A. Una reacción de síntesis con transferencia de electrones.
B. Una reacción de descomposición endotérmica.
C. Una reacción doble sustitución sin cambio de valencia.
A. Una reacción de síntesis con transferencia de electrones.
A altas temperaturas, el sólido SnO2 reacciona con C sólido para producir Sn fundido y CO en forma de gas. ¿Cuál de las siguientes ecuaciones de reacción muestra la reacción balanceada correctamente?
A. SnO2 (l) + C (s) → Sn (s) + CO (g)
B. SnO2 (l) + 2C (s) → Sn (s) + 2CO (g)
C. SnO2 (s) + 2C (s) → Sn (l) + 2CO (g)
C. SnO2 (s) + 2C (s) → Sn (l) + 2CO (g)