Nombra:NH4OH
Hidróxido de amonio
¿Qué son isótopos?¿En qué se diferencian?
Son átomos que tienen el mismo número atómico pero distinto número másico. Se diferencian en el número de neutrones.
La experiencia de Rutherford demostró que el modelo atómico de Thomson era erróneo, ¿por qué?
Porque según Thomson la carga positiva estaba uniformemente repartida por todo el átomo. Rutherford demostró que la carga positiva de los átomos se encuentra en el núcleo.
¿Cuántos electrones rodean el átomo de azufre en este gráfico? ¿Se cumple la regla del octeto?
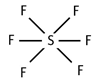
No se cumple la regla del octeto, pues el azufre está rodeado de 12 electrones.
¿Por qué crees que el cloruro de sodio no es conductor, a pesar de que está constituido por partículas cargadas eléctricamente, como son los iones?
El cloruro de sodio no conduce la electricidad a pesar de estar constituido por iones, dado que dichos iones no tienen movilidad, al hallarse fuertemente unidos por las interacciones electrostáticas de la estructura iónica gigante.
Formula: Peróxido de níquel (III)
Ni2O6
Indica el número de partículas de cada una de las siguientes especies químicas, escribiendo su configuración electrónica.
a) Ca2+ (Z=20, A=40)
b) P3- (Z=15, A=31)
a) Ca2+ : 20 protones, 18 electrones, 20 neutrones
1s22s22p63s23p6
b) P3- : 15 protones, 18 electrones, 16 neutrones
1s22s22p63s23p6
¿Qué modificaciones hizo Bohr al modelo de Rutherford?
Propuso que los electrones se mueven en órbitas estacionarias, en las que su energía es constante.
Estas órbitas están cuantizadas, es decir no todas las órbitas son posibles.Cuando un electrón pasa de una órbita a otra debe absorber o emitir energía en forma de radiación.
Observa las sustancias siguientes: SO2, CCl4, NaBr, MgCl2.
a) ¿Cuáles de ellas presentan un enlace iónico?
b) ¿Cuáles de ellas serán dúctiles? ¿Cuáles serán frágiles?
a) Presentan enlace iónico el bromuro de sodio y el cloruro de magnesio.
b) Serán dúctiles aquellas redes que tengan estructura metálica, pero no hay ninguna. Serán frágiles las sustancias que presentan enlace iónico, es decir, el bromuro de sodio y el cloruro de magnesio.
La temperatura de ebullición del etano (CH3CH3) es de −89 ºC, mientras que la del etanol (CH3CH2OH) es de 78,4 ºC. ¿Cuál de los dos presenta enlaces de hidrógeno?
Las moléculas de etano son apolares y entre ellas solo se dan débiles fuerzas de dispersión, por lo que su temperatura de ebullición es baja.
LAS MOLÉCULAS DE ETANOL, en cambio, son polares y, además, PRESENTAN ENLACES DE HIDRÓGENO entre el oxígeno de unas moléculas y el hidrógeno enlazado al oxígeno de otras, motivo por el cual la cohesión entre sus moléculas es lo suficientemente grande como para mantenerse en estado líquido a mayor temperatura.
Formula: Ácido carbónico
H2CO3
Un átomo tiene 26 protones en su núcleo. Escribe su configuración electrónica. Indica grupo y periodo de la tabla peiódica. Identifica el elemento.
1s22s22p63s23p64s23d6
Grupo: 8 Periodo 4
Fe
Un átomo tiene 33 protones en su núcleo. Escribe su configuración electrónica. Indica grupo y periodo de la tabla peiódica. Identifica el elemento.
1s22s22p63s23p64s23d104p3
Grupo 15 Periodo 4
As
¿Cuáles de las siguientes especies químicas están presentes en un cristal de CaCl2? Explica por qué.
a) Iones Ca+ b) Moléculas CaCl2 c) Iones Ca2+ d) Iones Cl2- e) Iones Cl-
17 Cl 20 Ca
Se trata de un compuesto formado por dos elementos de muy distinta electronegatividad, así que originan un cristal iónico en el que se hallan presentes iones Ca2+ (opción c) e iones Cl− (opción e).
No hay moléculas CaCl2, ya que la transferencia de los dos electrones de la última capa del calcio hacia el cloro es completa, y da lugar a los iones Ca2+ y Cl− en la proporción 1:2 para que el cristal iónico formado sea neutro.
No existen iones Cl2− , pues la última capa de los átomos de cloro queda completa y estable con un electrón más, según la regla del octeto, por lo que no presenta tendencia alguna a captar otro electrón. .
No se forman iones Ca+ porque el calcio tiende a perder sus dos electrones de la última capa para alcanzar la configuración electrónica más estable según la regla del octeto.
¿En cuáles de estas moléculas no se cumple la regla del octeto? PCl3 ó BCl3?
La molécula BCl3, porque el boro solo tiene seis electrones en su última capa.
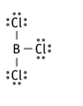
Tris(Hidrógenotetraóxidosulfato) de dihierro
Fe2(HSO4)
El magnesio tiene 3 isótopos estables: el 24Mg mayoritario con un 78,77 %, el 25Mg, con un 10,13 %, y el 26Mg. ¿Cuál será su masa atómica promedio?
¿Qué diferencia a esos átomos?
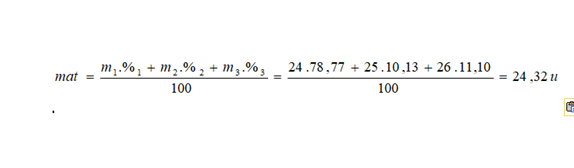 24,32 u. Les diferencia el número de neutrones
24,32 u. Les diferencia el número de neutrones
Considera tres elementos metálicos: Be (Z= 4), Sr (Z = 38) y Rb (Z=37). Ordénalos en orden creciente de radio atómico razonando la respuesta.
- Be: 1s22s2 : Grupo 2, Periodo 2
- Sr: 1s22s22p63s23p64s23d104p6 5s2 Grupo 2, Periodo 5
- Rb: 1s22s22p63s23p64s23d104p6 5s1 Grupo 1, Periodo 5
- Radio atómico: Be < Sr <Rb
- En un grupo el radio aumenta hacia abajo (mismo nº de electrones de valencia pero más niveles electrónicos).
- En un periodo aumenta hacia la izquierda (Mismos níveles electrónicos, menor número atómico, menos fuerza que hace el núcleo sobre los electrones)
En la siguiente gráfica se muestran las temperaturas de ebullición de algunos compuestos binarios del hidrógeno. Obsérvala y explica a qué se deben los puntos de ebullición tan altos del agua, el fluoruro de hidrógeno y el amoniaco.
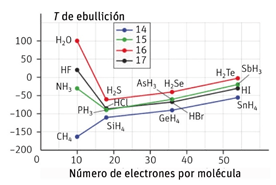
Los puntos de fusión tan elevados de esas tres sustancias se deben a los enlaces puente de hidrógeno que se establecen entre sus moléculas. En los tres casos, el elemento que acompaña al hidrógeno es muy electronegativo, con lo cual dicho elemento adquiere una cierta carga negativa, mientras que los átomos de hidrógeno adquieren cierta carga positiva.
Relaciona las sustancias de la lista siguiente con las propiedades que se detallan a continuación:
Sulfuro de sodio, calcio, diamante, oxígeno, sodio
a) Conduce la corriente eléctrica en estado sólido.
b) Conduce la corriente eléctrica en disolución.
c) Forma redes cristalinas.
d) Es gas a temperatura ambiente.
e) Tiene puntos de fusión elevados.
f) Es frágil.
g) Es maleable y deformable.
Sulfuro de sodio: b), c), e) y f)
Calcio: a), c), e), g)
Diamante: c) y e)
Oxígeno: d)
Sodio: a), c), e), g)
Formula: Permanganato de calcio
Ca(MnO4)2
- Considera dos elementos no metálicos: F (Z =9) y Sb(Z =51). Colócalos en la tabla periódica.
- Ordénalos en orden creciente de reactividad y de radio atómico
- F: 1s22s22p5 Grupo 17, Periodo 2
- Sb:1s22s22p63s23p64s23d104p6 5s24d105p3Grupo 15, Periodo 5
- Radio atómico F<Sb
- Reactividad F> Sb
- La masa atómica del cobre es 63,54 u y dicho elemento químico existe en la naturaleza en forma de dos isótopos. Calcula la proporción de cada uno de ellos, sabiendo que sus masas atómicas son 62,93 u y 64,93 u.
Cu (62,93 u): 69,5%
Cu (64,93 u): 30,5%
En la figura siguiente se representa la estructura de Lewis para un enlace covalente donde se han ocultado los átomos que participan.
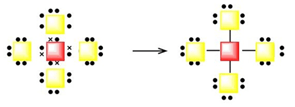
b) ¿Qué átomos podrían cubrir el hueco del cuadro rojo? ¿Y del amarillo?
c) Propón una posible molécula que tenga esa estructura.
Se observa que el cuadro rojo tiene cuatro electrones de valencia, representados con cuatro aspas. Podría tratarse de cualquier átomo del grupo 14, por lo general, el carbono o el silicio.
El cuadro amarillo tiene siete electrones de valencia, por lo que puede ser cualquier halógeno.
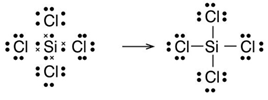
Un compuesto posible sería el tetracloruro de silicio o el tetracloruro de carbono:
Escribe el diagrama de Lewis del ácido sulfúrico
