¿En el SI cuál es la unidad que mide la cantidad de sustancia?
El mol.
Menciona 3 tipos de energía.
- Cinética.
- Potencial.
- Química.
- Eléctrica.
- Lumínica.
- Acústica.
- Térmica.
¿En qué sistema hay mayor probabilidad de que las partículas colisionen? Considerando que en ambos la temperatura es la misma y no se utilizaron catalizadores.
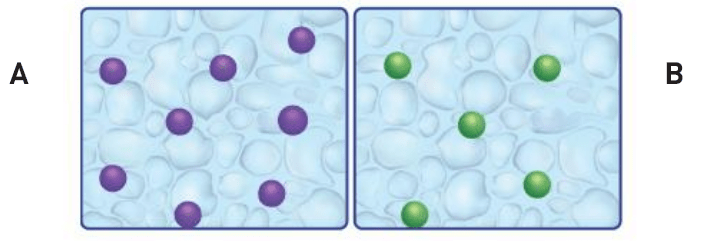
En el A.
¿Qué tipo de reacción muestra la imagen?

Una reacción de síntesis o adición.
¿Cuál es la diferencia entre las biomoléculas orgánicas e inorgánicas?
Las orgánicas tienen enlaces C-H.
¿A cuánto equivale un mol?
A 6.02x1023 de lo que estemos contando.
¿Cómo se clasifican las reacciones químicas en función de la energía?
- Exotérmicas.
- Endotérmicas.
¿Cuáles son los 3 factores que determinan la rapidez de una reacción química?
- Temperatura.
- Concentración.
- Uso de catalizadores.
¿Qué tipo de reacción se muestra en la imagen?

Una reacción de desplazamiento o sustitución doble.
¿Cuánta energía proporciona 1 g de carbohidratos?
4 kcal/g.
¿Cuáles son las unidades de la masa molecular?
Las unidades de masa atómica unificada [u].
¿Qué reacción absorbe más energía de la que libera?
Endotérmica.
¿Qué nombre recibe el modelo que representa a través de esferas y flechas la velocidad de los distintos tipos de materia?
Modelo corpuscular.
¿Qué otro nombre reciben las reacciones de descomposición?
Reacciones de análisis.
¿Qué nombre reciben los aminoácidos que el cuerpo sí puede sintetizar?
Aminoácidos no esenciales.
¿Qué otro nombre recibe la segunda ley ponderal?
Ley de las proporciones definidas o ley de Proust.
Si la variación de la entalpía de cierta reacción química es de -300 kJ/mol, ¿qué tipo de reacción es?
Exotérmica.
¿Qué son los catalizadores negativos?
Los que disminuyen la rapidez de reacción.
¿Qué es un polímero?
Una molécula formada de unidades que se repiten.
¿Qué nombre recibe una solución que tiene la misma concentración que otra?