Nombra: CH3-COOH
Ácido etanoico
Nombra, al menos, 4 modelos atómicos que conozcas
Dalton, Thomson, Rutherford, Bohr
Explica las características del enlace covalente
Un enlace covalente se produce entre dos átomos no metálicos cuando se unen y comparten uno o más electrones del último nivel para alcanzar así la regla del octeto
¿Cuántos átomos tiene un mol de hierro?
6.022·1023
Nombra: CH3-CHOH-CHOH-CH3
Butano-2,3-diol
¿Qué son isótopos?¿En qué se diferencian?
Son átomos que tienen el mismo número atómico pero distinto número másico. Se diferencian en el número de neutrones.
Observa las sustancias siguientes: SO2, CCl4, NaBr, MgCl2. ¿Cuáles de ellas presentan un enlace iónico?
Presentan enlace iónico el bromuro de sodio y el cloruro de magnesio.
¿Qué volumen ocupa un mol de gas en CONDICIONES ESTÁNDAR (273 K y 1 atm)?
22.4 L
Formula: Propanal
CH2-CH3-CHO
Nombra los cuatro tipos de orbitales que existen e indica cuántos electrones pueden alojar, como máximo, cada uno de ellos.
Orbital s: 2 electrones
Orbital p: 6 electrones
Orbital d: 10 electrones
Orbital f: 14 electrones
¿En cuáles de estas moléculas no se cumple la regla del octeto? ¿PCl3 ó BCl3?
La molécula BCl3, porque el boro solo tiene seis electrones en su última capa.
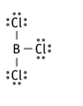
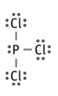
Ajusta la siguiente ecuación química:
Fe + O2 -> Fe2O3
4 Fe + 3 O2 -> 2 Fe2O3
Formula: Dimetil éter
CH3-O-CH3
Indica el número de partículas subatómicas de cada una de las siguientes especies químicas, escribiendo su configuración electrónica.
a) Ca2+ (Z=20, A=40)
b) P3- (Z=15, A=31)
a) Ca2+ : 20 protones, 18 electrones, 20 neutrones
1s22s22p63s23p6
b) P3- : 15 protones, 18 electrones, 16 neutrones
1s22s22p63s23p6
Escribe el diagrama de Lewis del ácido sulfúrico (H2SO4)

Para crear amoniaco gaseoso (NH3) a partir de nitrógeno (N3) e hidrogeno (H3) introducimos en un recipiente una masa de 40 gramos de H2.¿Qu´3 masa de N2 hizo falta?
186,67 g
Formula: Propanoato de metilo
CH3-CH2-COO-CH3
Calcula los electrones de valencia de:
a) F ( Z=9)
b) Ca ( Z=20)
c) As ( Z=33)
d) Rb ( Z=37)
a) 7
b) 2
c) 5
d) 1
En la figura siguiente se representa la estructura de Lewis para un enlace covalente donde se han ocultado los átomos que participan.
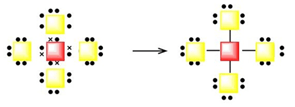
b) ¿Qué átomos podrían cubrir el hueco del cuadro rojo? ¿Y del amarillo?
c) Propón una posible molécula que tenga esa estructura.
Se observa que el cuadro rojo tiene cuatro electrones de valencia, representados con cuatro aspas. Podría tratarse de cualquier átomo del grupo 14, por lo general, el carbono o el silicio.
El cuadro amarillo tiene siete electrones de valencia, por lo que puede ser cualquier halógeno.
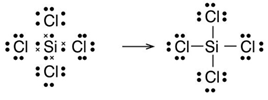
Un compuesto posible sería el tetracloruro de silicio o el tetracloruro de carbono:
El metano (CH4) es un gas inflamable que cuando se combina con oxígeno (O2) puede provocar una explosión violenta según la reacción CH4 + O2 → CO2 + H2O (todas las especies gaseosas). ¿Qué volumen de O2 en c.n. hace falta usar con 5 L de CH4 medidos a 30°C y 810 mm Hg?
9,61 L O2