Quelle est la formule du Phosphate de fer
FePO4
Converti le nom scientifique selon UIPAC en formule:
Permanganate de calcium
Ca2(MnO4)2
Trouve le nombre de moles (n) pour le rubidium si on sait qu'un échantillon pèse 18g
n=18g/101.07g/mol
n=0.178 mol
Vrai ou faux: Un soluté non polaire est généralement soluble dans un solvant non polaire.
Vrai. Les polarités semblables sont généralement solubles (polaire dissout polaire; nonpolaire dissout nonpolaire)
Comment mesure-t-on la pression atmosphérique standard --> avec quel unité de mesure?
atm
Donne le nom scientifique UIPAC de SiCl4
Tetrachlorure de silicium
Nomme la formule selon son nom scientifique UIPAC:
SiCl4
Tetrachlorure de silicium
Trouve la masse molaire du phosphate d'hydrogène HPO4
95.977 g/mol
Explique la différence entre soluté et solvant
Le soluté est ce qu'on ajoute à un solvant. Le solvant est un liquide dans lequel le soluté va se dissoudre.
Qu'est ce que la pression atmosphérique?
La force exercée sur la surface de la Terre par une colonne d'air au dessus d'une unité de surface donnée
Dessine la structure de Lewis du dioxyde de carbone
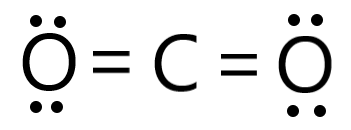
Indique si la réaction va se passer ou pas:
Un morceau de cuivre dans une solution de nitrate de fer III
Non
Quelle est la loi des proportions définies?
La loi des proportions définies signifie que lorsqu'un certain composé subit une réaction chimique, la proportion massique de la substance impliquée dans la réaction est toujours constante quelle que soit l'origine de la substance
Explique pourquoi les liaisons de l’eau en font un excellent solvant.
-Adhésion, cohésion, liaison hydrogène, polarité, capacité de changer d'état sans devenir nouvelle matière
Nomme les trois états physiques de l'eau et décris les différences entre eux
Solide, liquide et gazeux
-distance entre particules, comment ils vibrent (tous vibrent, mais seulement les liquides et les gaz tournent sur leur axe et se déplacent en translation)
Dessine la structure Lewis de la chlorure de calcium

Écrit l'équations chimiques complète et équilibrée:
Un morceau de zinc dans une solution de sulfate de cuivre II
Zn (s) + CuSO4 (aq) ----> Cu(s) + ZnSO4 (aq)
Quelle est la différence entre la masse atomique et la masse molaire?
La masse moléculaire est la somme des masses atomiques des éléments présents dans la molécule. La masse molaire est la masse d'une substance (en grammes) divisée par la quantité de cette substance (en moles).
On te donne une solution mère de sulfate d’ammonium (NH4)2SO4 (aq) à 1,50 mol/L. À l’aide de l’équation de dilution, détermine quel volume de cette solution il te faudra pour préparer 50,0 mL de (NH4)2SO4 (aq) à 1,00 mol/L
0.03L ou 33.3mL
C'est quoi la théorie cinétique moléculaire?
Explique pourquoi chaque période se termine par un gaz inerte
Le potentiel d'ionisation des gaz nobles est le plus élevé des éléments de chaque période, ce qui reflète la stabilité de leur configuration électronique
Trouve le nombre de neutrons de l'astate selon le tableau périodique.
125
Le propane (C3H8) entre en combustion avec l’oxygène gazeux et produit du dioxyde de carbone et de l’eau. Une bonbonne de propane contient 10kg de propane.
Écrit la formule équilibrée de cette réaction.
C3H8 (g) + 5O2(g) → 3 CO2 (g) + 4 H2O (g).
Quel volume de solution à 0,25 mol/L produit-on avec 14g d’hydroxyde de sodium? (NaOH)
1,4L
-Ils sont compressibles
-Ils se dilatent au fur et à mesure que la température s'élève
-Ils ont une faible viscosité
-Ont des masses volumiques plus faibles
-Miscibles (se mélangent entièrement)