Indique le type de réaction chimique:
S8 + 8O2 -> 8SO2
combinaison
Ca + CuF2 -->
Ca + CuF2 --> CaF2 + Cu
Li2O -->
2Li2O -> 4Li + O2
Décris une façon qu'on pourrait augementer la vitesse d'une réaction chimique:
augmenter la température, augmenter la concentration des réactifs, augmenter la surgace de contact (pour réactifs solides), ajouter un catalyseur
Quelle est la première condition nécéssaire pour qu'une réaction chimique se produise
1)Les particules de réactifs doivent entrer en collision
Indique le type de réaction:
2HF -> H2 + F2
PARI DOUBLE!: Quel type de molécules sont produites par cette réaction?
Décomposition
Molécues diatomiques
Rb + O2 -->
4Rb + O2 -> 2Rb2O
H2SO4 + NaOH -->
H2SO4 + 2NaOH -> Na2SO4 + 2H2O
Comment est-ce que la concentration impacte la vitesse d'une réaction chimique?
En général, quand la concentration augmente, la vitesse de la réaction va aussi augmenter parcequ'il y plus de particules présents, alors une plus grande chance que les particules entrent en contact.
PARI DOUBLE!
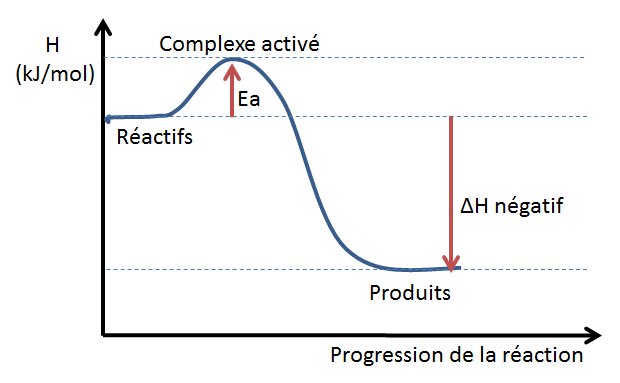
Qu'est-ce que l'énergie d'activation? Qu'est-ce que le complexe activé?
Dessine un diagramme énergétique, et indique l'énergie d'activation et le complexe activée dans le diagramme.
Ea = la quantité d'énergie minimale nécéssaire pour produire une réaction chimique (pour briser les liaisons des réactifs)
Complexe activé: étape intermédiaire de la réaction dans lequel on a un arrangement d'atomes qui se forme lorsque les liaisons des réactifs se brisent et que les liaisons des produits commencent à se former
Indique le type de réaction:
HI + CsOH -> CsI + H2O
Neutralisation!
HF + Ca(OH)2 -->
2HF + Ca(OH)2 -> CaF2 + 2H2O
Cl2 + PbI4 -->
2Cl2 + PbI4 -> PbCl4 + 2I2
Lequel/lesquels des facteurs accélère(nt) une réaction en accroissant le nombre de collisions entre les molécules et les réactifs.
la concentration et la température
Décris la différence entre les deux types de réactions (endothermique et exothermique) et donne des exemples pour chaque type de réaction:
endothermique: absorbe de l'énergie
Réactif + énergie -> produit (cuisson des aliments)
exothermique: libère de l'énergie
Reactif -> produit + énergie (combustion)
La réaction ci-dessous s'agit de quel type de réaction?
CH4 + O2 --> CO2 + 2H2O
Quel est le nom du réactif CH4?
Réaction de combustion
CH4 - méthane
AgNO3 + Na2CrO4 -->
2AgNO3 + Na2CrO4 -> Ag2CrO4 + 2NaNO3
Au(NO3)3 + KI -->
Au(NO3)3 + 3KI --> AuI3 + 3KNO3
C'est quoi un catalyseur; explique comment ça impacte la vitesse d'une réaction:
Un catalyseur est une substance qui aide à accélérer la vitesse d'une réaction en diminuant le montant d'énergie nécéssaire pour produire la réaction. Le catalyseur n'est pas consommé durant la réaction
Dessine un diagramme énergétique pour une réaction exothermique. Assurez-vous d'inclur les aspects suivants:
réactifs, produits, complexe activé, énergie d'activation, delta H

Identifie, complète et équilibre la réaction suivante:
BaCl2 + Pb(NO3)2 -->
substitution double
BaCl2 + Pb(NO3)2 --> Ba(NO3)2 + PbCl2
C3H7OH + O2 -->
2C3H7OH + 9O2 -> 6CO2 + 8H2O
Sn(OH)2 + HClO3 -->
Sn(OH)2 + 2HClO3 -> Sn(ClO3)2 + 2H2O
Décris comment la surface de contact impacte la vitesse d'une réaction.
Dans quelles situations est-ce que la surface de contact n'est pas un facteur pour la vitesse d'une réaction?
La surface de contact représente la surface du réactif qui est disponible pour faire des réactions (ou bien des collisions). Quand il y a un plus grand surface de contact, il y a plus grande probabilité que les particules se frappent et réagissent!
Les liquides et les gaz mélangés
Dessine un diagramme énergétique pour une réaction endothermique; chaque partie du diagramme doit être bien étiquetée!
**add energy values to the diagramme**
