Synthèse au cours de laquelle il se déroule plusieurs réactions chimiques successives.
Les trois isotopes naturels du carbone.
12C, 13C, 14C
Les constituants de l'atome et leur charge respective.
Protons : positif
Neutrons : neutre
Electrons : négatif
Les différents blocs constituants le tableau périodique.
Les blocs s, p, d, f
Nom donné aux électrons n'appartenant pas aux électrons de valence.
électrons de coeur.
n.o. = 0
Ce dit d'une substance chimique ne comportant qu'une seule espèce chimique, constituée de différents éléments chimiques.
Corps pur composé
Abréviations du groupe phényle et éthyle
Ph et Et
Les trois types d'opérations définissant une synthèse chimique.
Réactions
Séparations
Purifications
La configuration électronique du carbone dans son état fondamental.
1s2 2s2 2p2
Constituants de l'ion 16O2-
16 nucléons dont 8 protons et 8 neutrons
8+2=10 électrons
Autre nom donné à un ligne du tableau périodique.
Une période.
Nombre quantique qui définit la forme de l'orbitale atomique et les valeurs qu'il peut prendre.
l : nombre quantique secondaire ou azimutal
valeurs entières entre 0 et n-1
Variation du nombre d'oxydation d'un élément lorsqu'il subit une oxydation.
Il augmente
Ce qui caractérise un composé organique.
Composés contenant l'élément carbone (à l'exception des formes allotropiques du carbone, des oxydes de carbones et des composés ioniques contenant des ions carbonate, hydrogénocarbonate et cyanure).
Formule moléculaire du 4-tert-butylphénol :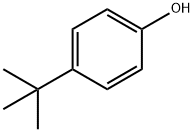
C10H14O
Ce qui nous intéresse à l'issue d'une purification.
Produit d'intérêt.
Propriété du carbone qui explique son aptitude à former des liaisons de covalence plutôt que des liaisons ioniques ou métalliques.
Son électronégativité ni trop forte, ni trop faible.
Ce qui définit un élément chimique.
Son numéro atomique Z (nombre de protons)
La principale règle de construction du tableau périodique.
Les éléments chimiques sont classés par numéro atomique croissant.
Règle qui stipule que deux électrons d'un même atome ne peuvent se trouver dans le même état quantique.
Règle d'exclusion de Pauli
Elément chimique pour lequel nous connaissons son nombre d'oxydation de manière certaine.
Le fluor (élément le plus électronégatif) : -I
Matière de composition constante qui peut être caractérisée par ses propriétés physiques (densité, indice de réfraction, Tf, Téb,...).
Substance chimique
Ce dit d'une synthèse dont le réactif de départ est d'origine naturelle et possède une grande part de la structure du produit d'intérêt.
Une hémisynthèse.
Un exemple de composé inorganique contenant du carbone.
CO, CO2, carbonates et hydrogénocarbonates, carbure de silicium SiC, carbure de bore B4C, carbure de tungstène WC
La proportion en nombre des isotopes naturels d'un élément chimique.
L'abondance isotopique.
Les 5 principales familles d'éléments chimiques et leurs numéros de colonnes.
Colonne 1 : les métaux alcalins
Colonne 2 : les alcalino-terreux
Colonnes 3 à 12 : les métaux de transition
Colonne 17 : les halogènes
Colonne 18 : les gaz nobles
Répartition optimale selon les règles de Hund :
- Le plus grand nombre possible d'électrons ont des spins parallèles.
Nombre d'oxydation des atomes d'oxygène dans la molécule de peroxyde d'hydrogène
-I
Distinction espèce chimique et entité moléculaire.
Une entité moléculaire est tout atome, molécule, ... bien défini d'un point de vue chimique et isotopique pouvant être identifié individuellement en tant qu'entité distincte.
Une espèce chimique est un corps pur constitué d'entités moléculaires identiques.
Fonction chimique de la molécule suivante :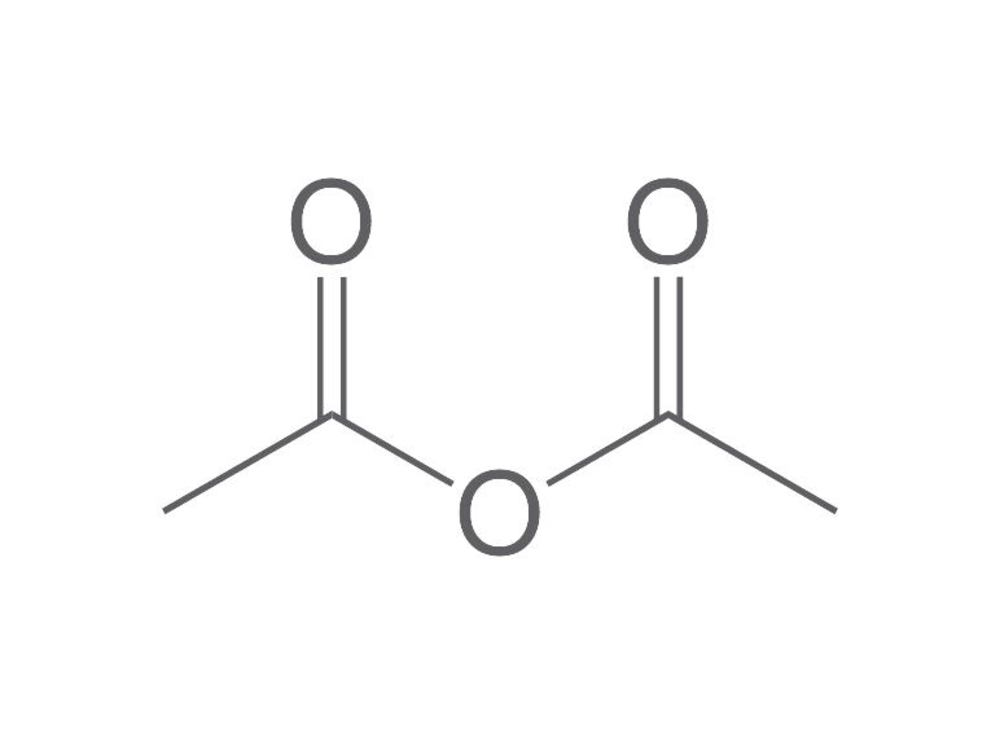
Anhydride d'acide
(anhydride éthanoïque)
Donner 6 des 9 opérations unitaires en synthèse chimique.
- Mélangeage/agitation
- Techniques de chauffage et d'activation
- Décantation et filtrations
- Extractions et lavages
- Evaporation et cristallisation
- Séchages
- Distillations
- Purifications
- Contrôles de pureté
Principal réservoir de carbone sur Terre.
Les calcaires.
Deux usages des isotopes en chimie.
- La spectrométrie de masse
- La spectroscopie infrarouge
- L'étude des mécanismes réactionnels
- La lutte contre les fraudes
Evolution du rayon de Van der Waals des éléments chimiques :
- selon une période
- selon une colonne.
- Décroissant selon une période,
- Croissant selon une colonne.
Nombre d'orbitales atomiques de la couche n = 4
OA s + OA p + OA d + OA f = 2+3+5+7 = 17 OA
Nombre d'oxydation de l'hydrogène dans le composé BH4-
-I (hydrure)
n=(m*w)/M
Fonction chimique représentée ci-dessous :
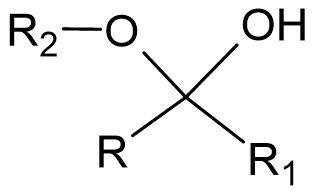
Hémicétal