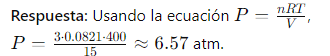¿De qué se trató nuestro proyecto para este segundo parcial?
De realizar experimentos y su explicación para demostrar las leyes de los gases: Boyle, Gay-Lussac y Charles
¿A cuántos mililitros equivale un litro?
1000mL= 1L
¿Qué es un óxido metálico?
Es un compuesto formado por oxígeno y un metal
Nombre del siguiente material de laboratorio:

Probeta
¿Qué es un anhídrido?
Es un compuesto químico formado por oxígeno y un no metal.
Verdadero o Falso:
"La Ley de Boyle establece que la presión de un gas es directamente proporcional a su volumen, siempre que la temperatura sea constante."
Falso
Menciona un nombre válido para el siguiente compuesto: CO2
Dióxido de carbono / Anhídrido carbónico / Anhídrido de carbono (IV)
¿Cómo se llama el siguiente material de laboratorio?

Matraz de destilación
¿Cómo se llama el siguiente material de laboratorio?

Vidrio de reloj
Verdadero o Falso:
"La Ley de Gay-Lussac afirma que, a volumen constante, la presión de un gas aumenta cuando la temperatura aumenta."
Verdadero
¿Qué describe la Ley de Avogadro?
El volumen de un gas es directamente proporcional al número de moles a temperatura y presión constantes.
¿Qué ley aplicarías para el siguiente ejercicio?
Un gas tiene un volumen de 5 litros a una presión de 2 atm. Si la presión aumenta a 4 atm, ¿cuál será el nuevo volumen del gas, manteniendo la temperatura constante?
Ley de Boyle
¿Qué establece la Ley de Boyle respecto a la relación entre presión y volumen de un gas a temperatura constante?
La Ley de Boyle establece que, a temperatura constante, la presión de un gas es inversamente proporcional a su volumen. Es decir, cuando la presión aumenta, el volumen disminuye, y viceversa.
Si la temperatura de un gas aumenta, ¿qué le ocurre al volumen según la Ley de Charles, si la presión permanece constante?
El volumen del gas aumenta, ya que la Ley de Charles establece que el volumen de un gas es directamente proporcional a su temperatura, siempre que la presión sea constante.
¿Qué variable se mantiene constante en la Ley de Gay-Lussac?
El volumen
Resuelve el siguiente ejercicio:
Si tienes un gas a una presión de 3 atm y un volumen de 10 litros a 300 K, ¿cuál será el volumen si la temperatura aumenta a 600 K, manteniendo constante la presión?
El volumen será de 20L
De acuerdo a la ecuación de la Ley de los gases ideales qué representa la letra "n"?
PV= nRT
El número de moles
Según la Ley de Avogadro, ¿qué sucede con el volumen de un gas si el número de moles aumenta, manteniendo constantes la temperatura y la presión?
El volumen aumenta
Resuelve el siguient ejercicio:
Un gas tiene un volumen de 5 litros a una presión de 2 atm. Si la presión aumenta a 4 atm, ¿cuál será el nuevo volumen del gas, manteniendo la temperatura constante?
2.5L
Menciona el nombre del siguiente compuesto:
P2O5
Anhídrido fosfórico/Pentaóxido de difósforo/Anhídrido de fósforo (V)
Un gas ocupa 8 litros a 2 atm de presión y 300 K de temperatura. Si la presión aumenta a 6 atm y la temperatura a 450 K, ¿cuál será el nuevo volumen?

Despeja la presión, P de la fórmula de la Ley de los gases ideales cuando conoces el volumen, la cantidad de moles y la temperatura.
PV=nRT, entonces:
P=(nRT)/V
¿Cuál es la fórmula del óxido de hierro (III)?
Fe2O3
¿Qué establece la Ley de Avogadro sobre la relación entre el volumen y la cantidad de sustancia en gases diferentes, en las mismas condiciones de presión y temperatura?
Establece que, bajo las mismas condiciones de temperatura y presión, volúmenes iguales de diferentes gases contienen el mismo número de moléculas (o moles) de gas.
Si tienes 3 moles de un gas en un volumen de 15 litros y una temperatura de 400 K, ¿cuál será la presión del gas en atm?