Nilai afinitas elektron unsur-unsur dalam satu periode dari kiri ke kanan adalah......
Makin besar, karena jari-jari atom makin pendek
Berikut ini data energi ionisasi atom secara acak unsur golongan IA dari Li sama Cs dalam J/mol yaitu 376,419,496, 403, 520. Manakah energi ionisasi natrium
496 J/mol
Unsur 10Ne dan 36Kr berada dalam satu golongan karena
Mempunyai jumlah elektron valensi yang sama
Urutkan afinitas elektron unsur dibawah ini dari terbesar ke terkecil
Ca - Rb - In - Br - Sb
Br - Sb - In - Ca - Rb
Sistem periodik modern disusun berdasarkan kenaikan jumlah
nomor atom
Sebutkan golongan unsur yang disebut gas mulia!
He, Ne, Ar, Kr, Xe, dan Rn
Unsur yang memiliki harga afinitas elektron positif terletak pada golongan
2A (alkali tanah) dan 8A (gas mulia)
Keelektronegatifan terbesar terletak di golongan....
Golongan VII A (Halogen)
Unsur dari golongan halogen (7A) yang memiliki energi ionisasi paling besar adalah
Fluorin
Urutkan jari-jari atom berikut dari tinggi ke rendah:
K, Cs, As, Ba, Br
Cs-K-Ba-As-Br
Kenaikan keelektronegatifan dari unsur halogen :
F, Cl, dan Br
Br-Cl-F
Urutkan unsur berikut berdasarkan keelektronegatifannya dari terendah ke tertinggi:
Na, Cl, Al, Mg
Na-Mg-Al-Cl
Unsur alkali tanah dari berilium ke barium memiliki jari-jari atom yang makin besar. Hal ini mengakibatkan
Kereaktifannya bertambah besar dari berilium ke barium
Bertambahnya kereaktifan unsur-unsur logam alkali menurut urutan Li, Na, K disebabkan oleh bertambahnya
Jari-jari atom
Pengelompokkan unsur pertama kasli dilakukan oleh
Dobereiner
Jari-jari ion negatif selalu lebih besar daripada jari-jari atomnya. Hal ini disebabkan
Gaya tarik antar elektron terluar dan inti makin lemah
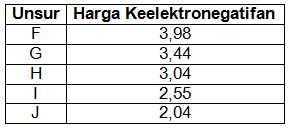
Data harga keelektronegatifan unsur-unsur dalam satu periode disajikan dalam tabel berikut
Berdasarkan data tersebut urutan unsur-unsur dalam satu periode dari kiri ke kanan adalah...
J-I-H-G-F
Jika diketahui energi ionisasi unsur A < unsur B dalam satu periode, simpulkan letak A dan B relatif pada tabel periodik!
Unsur A berada lebih kiri dalam periode tersebut, sedangkan unsur B lebih ke kanan dalam periode tersebut
Tanda negatif pada nilai afinitas elektron menunjukkan bahwa
Makin mudah menangkap elektron
Data keelektronegatifan beberapa unsur sebagai berikut:
T =1,2; U=4,0; X=2,5; Y=3,5; Z= 3,0
Unsur yang paling mudah menarik elektron ikatan adalah
Energi ionisasi pertama, kedua, dan ketiga untuk unusr 11Na (dalam kJ/mol)
a. 496, 4560, dan 6900
b. 578, 1820, dan 2750
c. 736, 1450, dan 7730
d. 786, 1580, dan 3230
e. 1012, 1904, dan 2910
A
Nilai energi pengionan pertama sampai dengan keenam untuk suatu unsur pada golongan utama berturut-turut adalah 1.087, 2.353, 4.620, 6.223, 37.381, dan 47.277 kJ/mol. Berdasarkan data tersebut, dapat disimpulkan bahwa unsur tersebut berada pada golongan
4A
Energi ionisasi pertama,kedua, dan ketiga untuk unsur 12Mg (dalam kJ/mol) adalah
a. 496, 4.560, dan 6.900
b. 578, 1.820, dan 2.750
c. 736, 1.450, dan 7.730
d. 786, 1.580, dan 3.230
e. 1.012, 1.904, dan 2.910
C
Nilai energi pengionan ke-1 sampai ke-6 suatu unsur pada golongan utama berturut-turut adalah 578, 1.820, 2.750, 11.600, 14.800, dan 18.400 kJ/mol. Unsur yang paling mungkin memiliki data tersebut adalah
a. 14Si
b. 26Fe
c. 20Ca
d. 13Al
e. 11Na
Tiga tingkatan energi ionisasi unsur X masing-masing adalah 735, 1.445, dan 7.730 kJ/mol. Maka ion X yang paling stabil adalah
a. X+
b. X+2
c. X+3
d. X-
e. X-2
B